Wenn Antibiotika versagen Multiresistente Erreger (MRE)
Immer mehr Erreger reagieren nicht mehr auf Antibiotika, die wichtigsten Medikamente im Kampf gegen schwere bakterielle Infektionen. Besonders bedenklich: Keime entwickeln zunehmend Schutzmechanismen gegen mehrere antibiotische Wirkstoffgruppen. Diese multiresitenten Keime (MRE) bedrohen die Gesundheit von Millionen Menschen in Deutschland, Europa und weltweit.
aktualisiert: Februar 2020

Keime und Infektionen
Experten der Berliner Charité befürchten, dass 2050 mehr Menschen an multiresistenten Keimen sterben könnten als an Krebs. Die wichtigsten Gegenmaßnahmen: konsequente Hygiene und weniger Antibiotika einsetzen.
Wissenschaftler gehen davon aus, dass etwa 100 Billionen Bakterien auf der Haut, in Mund, Magen und Darm des Menschen leben. Die meisten von ihnen braucht der menschliche Organismus, um gesund zu bleiben. Zum Beispiel Staphylokokken und Streptokokken: Sie gehören zur normalen Bakterienflora von Menschen und Tieren, so die Autoren des aktuellen Berichts zur Deutschen Antibiotika-Resistenzstrategie (DART 2020). Auch Listerien und Clostridien besiedeln Lebewesen. E.coli-Bakterien produzieren Vitamine in der menschlichen Darmflora.
Einige Arten dieser Bakterienfamilien können aber auch krank machen:
- Staphylococcus aureus löst die meisten Wundinfektionen aus,
- einige Streptokokken-Arten verursachen eitrige Mandelentzündungen, Lungenentzündungen oder Scharlach,
- bestimmte Clostridien führen zu Botulismus oder Wundstarrkrampf (Tetanus),
- eine Listerienart verursacht Lebensmittelvergiftungen,
- Klebsiella pneumoniae kann Lungenentzündungen verursachen,
- E.coli ist mitunter für schwere Darminfektionen verantwortlich.
Schwachstelle Immunsystem
Am effektivsten schützt ein intaktes Immunsystem den Organismus vor Krankheitserregern wie Bakterien. Ist das Immunsystem jedoch geschwächt, steigt das Risiko gefährlicher Infektionen. Besonders für Menschen mit angeborenen oder erworbenen Immundefekten, Frühchen, ältere Menschen und Intensivpatienten stellen multiresitente Keime eine besondere Gesundheitsgefahr dar.
Gesund – aber Keimträger
Nicht jeder Mensch, der die Erreger in oder auf sich trägt, erkrankt automatisch. Mediziner bezeichnen solche Patienten als „asymptomatische Keimträger“. Sie können anderen dennoch gefährlich werden – wenn sie etwa nach einer Infektion mit E.coli-Bakterien den Erreger unbemerkt weiter ausscheiden und so die Krankheit unwissentlich verbreiten.
Krankenhausinfektionen mit multiresistenten Keimen
In Deutschland infizieren sich jährlich zwischen 400.000 und 600.000 Menschen, die im Krankenhaus stationär behandelt werden, mit gefährlichen Keimen (nosokomiale Infektionen). 10.000 bis 15.000 der Betroffenen sterben daran. Auch weltweit verschärft sich die Situation: Forscher befürchten, dass die Zahl der Toten ohne Gegenmaßnahmen von aktuell etwa 700.000 pro Jahr bis 2050 auf zehn Millionen steigen könnte.
Multiresistenz – was bedeutet das?
Bakterien verfügen von Natur aus über die Fähigkeit, sich gegen andere Mikroorganismen zu schützen (Resistenz). Diese Widerstandskraft verdanken sie bestimmten Genen ihres Erbguts, die durch natürliche Mutationen entstehen. Zusätzlich können Bakterien Gene aber auch an andere Bakterien weitergeben und von diesen aufnehmen. Wenn bei diesem Austausch mehrere Resistenz-Gene in ein Bakterium „einwandern“, können diese Erreger schließlich mehreren Antibiotika widerstehen – sie werden zu multiresistenten Erregern (MRE). Sowohl grampositive als auch gramnegative Erreger können sich zu MRE entwickeln.
Angeborene Immundefekte treten hierzulande eher selten auf. Experten schätzen, dass etwa 100.000 Menschen in Deutschland daran leiden. Häufiger schwächen Medikamente die körpereigene Abwehr. Manche Erkrankungen können Ärzte zum Beispiel nur durch Medikamente behandeln, die das Immunsystem bremsen. Zu den Patienten mit einer erworbenen Immunschwäche gehören auch Menschen, die sich mit HIV angesteckt haben. Das Virus befällt für das Immunsystem wichtige Zellen und macht es Bakterien leichter, den Organismus zu infizieren.
Mit fortschreitendem Alter büßt das Immunsystem an Wirksamkeit ein. Die körpereigene Abwehr kann immer schlechter zwischen eigenen und fremden Zellen unterscheiden. Das gilt auch für eindringende Bakterien. Experten gehen davon aus, dass alte Menschen ähnlich anfällig für Infekte sind wie Patienten, deren Immunsystem aufgrund einer Grunderkrankung oder einer medikamentösen Behandlung geschwächt ist.
Patienten, die intensivmedizinisch betreut werden müssen, sind für bakterielle Infektionen besonders anfällig. Lebensbedrohliche Grunderkrankungen, schwere Operationen und starke Medikamente schwächen ihren Organismus. Auch lebenserhaltende Maßnahmen bieten Bakterien viele Möglichkeiten, von außen in den Organismus einzudringen – zum Beispiel über Beatmungsschläuche, Infusionen, Magensonden und Katheter.
Das Immunsystem von sehr kleinen Frühgeborenen kann Bakterien noch nicht wirksam bekämpfen. Der Grund: Für Ungeborene übernimmt vor allem das mütterliche Immunsystem die Erregerabwehr. Erst im letzten Drittel der Schwangerschaft lernt das Immunsystem des Kindes um. Bis dahin sind die Zellen, die Proteine des Immunsystems produzieren, noch nicht voll entwickelt. Deshalb verlaufen Infektionen bei Frühchen häufig sehr schwer; jeder normalerweise harmlose
MRGN – Keime schützen sich mit Enzymen
Vor allem die multiresistenten gramnegativen Erreger (MRGN) stellen die Medizin vor neue Herausforderungen. Manche dieser Bakterienstämme produzieren bestimmte Enzyme, um sich vor Antibiotika zu schützen. Je nachdem, ob die Erreger gegen drei oder vier Antibiotikagruppen resistent sind, sprechen Mediziner von 3MRGN bzw. 4MRGN.
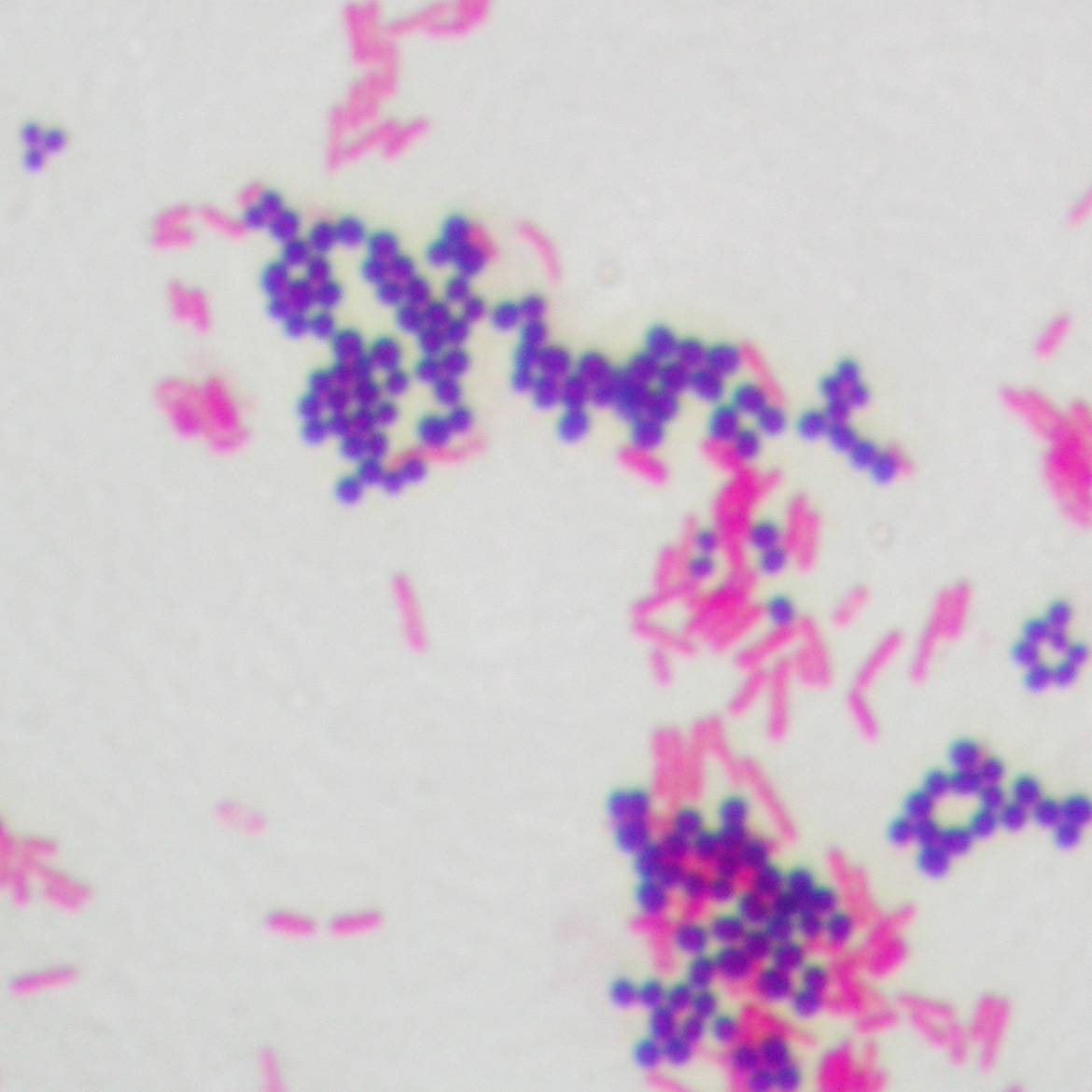
Gram? Positiv? Negativ? – Bakterien unterm Mikroskop
Der dänische Mediziner Hans Christian Joachim Gram entwickelte 1884 ein Verfahren, das Bakterien in infiziertem Gewebe mikroskopisch per Färbung sichtbar macht (Gram-Färbung). Grampositive Bakterien erscheinen unterm Mikroskop blau, gramnegative Bakterien rot. Ob ein Bakterium grampositiv oder gramnegativ ist, spielt für die Behandlung mit Antibiotika eine wichtige Rolle: Die verschiedenen Wirkstoffe helfen nicht bei allen Bakterienstämmen gleichermaßen gut.

Über- und FehlversorgungWarum Resistenzen entstehen
Je häufiger Antibiotika eingenommen werden, desto besser können Bakterien sich an die Wirkstoffe anpassen und Resistenzen gegen bestimmte Antibiotikaklassen entwickeln. Studien belegen immer wieder, dass Patienten in Deutschland zu häufig und unnötig Antibiotika einnehmen. So ergab etwa eine Umfrage der DAK, dass ein Viertel der Patienten mit den Medikamenten eine Bronchitis, ein Fünftel eine Erkältung und 15 Prozent Husten bekämpfen wollten. Da diese Erkrankungen jedoch auf Viren zurückgehen, helfen Antibiotika gar nicht. Auch die Mediziner der Deutschen Gesellschaft für Infektiologie sehen in unsachgemäßen Verordnungen und Fehlern bei der Einname der Medikamente einen wesentliche Ursache dafür, dass Resistenzen entstehen. Ohne Not geschluckt, schaden Antibiotika sie sogar: Die Wirkstoffe töten nicht nur die krankmachenden Erreger ab, sondern auch die wichtigen Bakterien in der Darmflora – womit der Körper wiederum anfälliger für Infektionen wird. Mangelnde Mitarbeit der Patienten birgt ebenfalls Gesundheitsrisiken. Wer die Medikamente zu früh absetzt oder unregelmäßig schluckt, provoziert häufig einen Rückfall – und muss dann erneut und unter Umständen deutlich länger Antibiotika einnehmen.
Positive Entwicklung Antibiotikaverordnungen niedergelassener Ärzte gehen deutlich zurück
Die Verordnungen von Antibiotika durch niedergelassene Ärzte sind in den letzten Jahren in ganz Deutschland und für alle Altersgruppen signifikant zurückgegangen. Das zeigt eine 2019 veröfentlichte Versorgungsatlas-Studie des Zentralinstituts für die kassenärztliche Versorgung (Zi). Wurden den GKV-Versicherten im Jahr 2010 noch 562 Verordnungen pro 1.000 Versicherte ausgestellt, waren es 2018 nur noch 446. Das ist ein Rückgang um insgesamt 21 Prozent. Besonders stark rückläufig (−41 Prozent) waren Verordnungen insbesondere für Kinder und Jugendliche (Alterssegment 0–14 Jahre). Bei Neugeborenen und Säuglingen (0–1 Jahr) wurde der deutlichste Rückgang beobachtet. Hier hat sich die Verordnungsrate von 2010 bis 2018 fast halbiert: Von 630 Verordnungen im Jahr 2010 ging die Rate auf 320 Verordnungen pro 1.000 Versicherte im Jahr 2018 zurück (−49 Prozent). Ein Grund für den signifikanten Rückgang der Verordnungsraten könnten die zahlreichen bundesweiten Initiativen zur Stärkung eines angemessenen Antibiotikaeinsatzes (bekannt unter der englischsprachigen Bezeichnung „Antibiotic Stewartship“) in Deutschland sein.

Risiko Massentierhaltung
Nicht nur Menschen werden mit Antibiotika behandelt. Auch Tiere erhalten diese Wirkstoffe, um Infektionen zu behandeln – und geben sie über den Verzehr an Menschen weiter. Studien haben ergeben, dass ein Schwein innerhalb seiner ungefähr 115-tägigen Mast an durchschnittlich vier Tagen Antibiotika erhält, ein Hähnchen mit einer durchschnittlichen Mastdauer von 39 Tagen sogar an zehn Tagen. Auch so entstehen Keime, die auf Antibiotika nicht mehr ansprechen.
Multiresistenz und Diagnostik
Multiresistente Keime lassen sich nur bekämpfen, wenn sie entdeckt werden – und wenn Mediziner wissen, wie sich die Resistenzlage in ihrer Region, in Deutschland, Europa und weltweit entwickelt. Darum spielt die labormedizinische Diagnostik eine wesentliche Rolle im Kampf gegen Multiresistenzen.
Viel hilft viel
Studien verschiedener Krankenhäuser zeigen: Werden die Patienten regelmäßig und häufig auf multiresistente Keime untersucht (Screening), steigt zwar die Zahl der entdeckten Keimträger. Da diese jedoch früh konsequent behandelt werden können, treten deutlich weniger schwere Infektionen auf. So etwa im Universitätsklinikum Greifswald: Durch intensives Screening sank die Rate der Neuinfektionen mit Krankenhauskeimen von 2008 bis 2011 von 0,45 Prozent auf 0,1 Prozent.
Beobachten und früh erkennen
Bakterien kennen keine Grenzen. Vor allem die Globalisierung und die zunehmende Patientenmobilität erfordern aus Expertensicht ein effektives Überwachungs- bzw. Frühwarn- und Reaktionssystem für resistente Infektionserreger. In Deutschland sammeln seit 2007 Experten des Robert Koch-Instituts (RKI) mit dem Überwachungssystem ARS (Antibiotika-Resistenz-Surveillance) Laborergebnisse aus dem ambulanten und stationären Bereich und erstellen daraus Statistiken. Diese fungieren unter anderem als Frühwarnsystem für neu auftretende Resistenzen. Das ARS arbeitet außerdem mit europäischen Surveillance-Systemen wie EARS-Net zusammen.
Schmal, Breit, Reserve – das richtige Antibiotikum wählen
Antibiotikum ist nicht gleich Antibiotikum. Neben Wirkstoffen, die ganz gezielt nur bestimmte Erreger bekämpfen (Schmalspektrumantibiotika), existieren auch Präparate, die gleichzeitig gegen mehrere Bakterienstämme wirken (Breitbandantibiotika). Reserveantibiotika wiederum sollten nur gegen sehr schwere Infektionen eingesetzt werden und wenn alle anderen Wirkstoffe versagen. Ebenfalls wichtig: Antibiotika sollten möglichst rational eingesetzt werden – so viel wie nötig, so wenig wie möglich. In vielen nordeuropäischen Ländern müssen klinische Mikrobiologen genehmigen, dass Antibiotika verabreicht werden. Die Häufigkeit von Resistenzen liegt dort bei nur 14 Prozent. In Mitteleuropa sind es 25 Prozent.
Schmalspur statt Breitband
Wissenschaftler des Zentralinstituts für die Kassenärtzliche Versorgung (ZI) sowie Experten des Bundesamts für Verbraucherschutz und Lebensmittelsicherheit (BVL) stellten in einer Studie fest: Statt zielgerichtet ein Antibiotikum auszuwählen, werden oft Breitbandwirkstoffe verschrieben. Daten der DAK bestätigen diese Tendenz. 2013 verordneten Mediziner am häufigsten Amoxicillin, Cefuroxim und Ciprofloxacin – alle drei Wirkstoffe gehören zu den Breitbandantibiotika. Diese sollten erst zum Einsatz kommen, wenn spezifische Wirkstoffe nicht wirken.
Reserveantibiotika nicht unnötig antasten
Noch problematischer wird es, wenn Mediziner ohne Notwendigkeit auf Reserveantibiotika zurückgreifen. Im englischen Sprachraum heißen diese Medikamente „drugs of last resort“ – die letzte Zuflucht bzw. Behandlungsoption bei schweren Infektionen und gegen Erreger, die auf drei oder mehr antibiotische Wirkstoffe nicht mehr reagieren. 2013 gehörte nach Angaben der DAK jedoch mehr als jedes fünfte verordnete Antibiotikum in Deutschland zu dieser eisernen Reserve, oft ohne zwingenden Grund. Experten fordern, Reserveantibiotika so wenig wie möglich einzusetzen. Nur so lässt sich sicherstellen, dass es im Notfall noch Medikamente gibt, die den Patienten helfen.
Multiresistente Erreger im Überblick
Grampositive MRE
Als besonders problematisch galten Medizinern in Deutschland lange Zeit vor allem MRSA: Bakterien vom Stamm Staphylococcus aureus, die gegen den antibiotischen Wirkstoff Methicillin resistent geworden sind (Methicillin-resistente Staphylococcus aureus). Die grampositiven Erreger verursachen viele der gefürchteten Krankenhausinfektionen (nosokomiale Infektionen), verbreiten sich aber auch schnell in Pflegeeinrichtungen. Im klinischen Sprachgebrauch bedeutet MRSA zudem „multiresistenter Staphylococcus aureus“, da die allermeisten MRSA-Stämme inzwischen auch anderen Antibiotika-Gruppen widerstehen. Erfreulicherweise nehmen MRSA im deutschen Gesundheitswesen nach einem starken Anstieg zwischen 2009 und 2012 wieder ab.
Enterokokken besiedeln üblicherweise den menschlichen Darm. Lange werteten Mediziner die grampositiven Bakterien als harmlos. Inzwischen weiß man, dass sie am dritthäufigsten Krankenhausinfektionen auslösen. Dazu gehören auch E.faecium-Erreger. Diese reagieren immer seltener auf den Wirkstoff Vancomycin. Mediziner bezeichen sie daher als Vacomyzinresistente Erreger (VRE). VRE verursachen inzwischen fast jede achte nosokomiale Infektion. 2007 waren es nur vier Prozent.
Gramnegative MRE
Vor allem E.coli- und Klebsiella-Stämme bilden sogenannte Betalaktamasen. Diese Enzyme können ein breites Spektrum Betalaktamhaltiger Antibiotika zersetzen und so deren Wirkung unterlaufen. Mediziner bezeichnen diese Erreger als Extended-Spectrum Beta-Lactamases, kurz ESBL. Inzwischen wirken bei diesen Erregern auch moderne Antibiotika der dritten Generation nicht mehr. Das betrifft sowohl stationäre als auch ambulante Patienten: Nach Angaben des Robert Koch-Instituts (RKI) stieg die Resistenzrate von 2008 bis 2013 in beiden Bereichen deutlich an.
Besonders riskant wird es, wenn Bakterien Reserveantibiotika aushebeln. Dies gilt etwa für Bakterien, die eine Resistenz gegen Wirkstoffe aus der Gruppe der Carbapeneme entwickelt haben. Laut Experten des RKI beeinträchtigt dies die Behandlungsmöglichkeiten schwerer Infektionen deutlich. Solche Resistenzen können durch unterschiedliche Mechanismen entstehen. Besonders besorgt beobachten Mediziner, dass immer mehr gramnegative Bakterien Carbapenemase produzierenden – Enzyme, die neben den Carbapenem-Antibiotika auch noch fast alle anderen Betalaktam-Antibiotika zerstören können.

Strategien gegen Multiresistenzen
Werden resistente Krankheitserreger frühzeitig erkannt, lässt sich ihre Ausbreitung durch verschiedene Maßnahmen verhindern. Screening und ausreichende Hygiene sind Schlüssel dafür, Patienten vor Krankenhauskeimen zu schützen.
Sauber, sauber!
Gerade dort, wo viele Kranke über längere Zeit zusammenkommen, kann es nicht sauber genug zugehen. Krankenhäuser und Pflegeeinrichtungen lassen sich nicht keimfrei machen. Ein konsequentes Hygienemanagement reduziert aber das Infektionsrisiko. 2011 verpflichtete der deutsche Gesetzgeber die Einrichtungen des Gesundheitswesens verstärkt dazu, innerbetriebliche Verfahrensweisen zur Infektionshygiene festzulegen. Da etwa MRSA sich vor allem über Händekontakt verbreiten, gehört eine strenge Handhygiene zu den wichtigsten Schutzmaßnahmen gegen die Erreger.
Screening von Risikopatienten
Hygienepläne sorgen dafür, die bereits im Krankenhaus vorhandenen Keime in Schach zu halten. Untersuchungen von Risikopatienten bei der Aufnahme ins Krankenhaus sollen dabei helfen, keine weiteren Keime einzuschleppen. Dieses Vorgehen empfiehlt die Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO). Bis die Ergebnisse der Labortests feststehen, müssen die Patienten isoliert werden. Diese Empfehlung gilt seit 2012 nicht mehr nur für MRSA, sondern auch für bestimmte MRGN, die bereits gegen mehrere Antibiotikagruppen resistent sind. Experten fordern weitere Verbesserungen. Die Deutsche Stiftung Patientenschutz etwa verweist auf die Niederlande. Dort untersuchen Krankenhausmediziner standardmäßig jeden neu aufzunehmenden Patienten, wenn er einer Berufsgruppe angehört, die regelmäßig mit Keimen Kontakt hat.

PatiententippsDas können Sie selbst tun!
Ob sie sich mit bestimmten Keimen infizieren, können Patienten trotz aller Hygienemaßnahmen nicht immer beeinflussen. Anders sieht es jedoch beim Umgang mit Antibiotika aus. Hier stehen Verbrauchern viele Möglichkeiten offen, den sinn- und maßvollen Einsatz mit den wichtigen Medikamenten mitzugestalten.
Bitten Sie Ihren Arzt, ein Antibiogramm zu erstellen, bevor er Ihnen ein bestimmtes Antibiotikum verschreibt. Ausnahme: schwere Infektionen, die schnell behandelt werden müssen.
Antibiotika wirken ausschließlich gegen Bakterien. Erkältungen werden hingegen in der Regel durch Viren ausgelöst – gegen diese Erreger sind Antibiotika machtlos. Verzichten Sie daher auch bei heftigen Erkältungen darauf, Ihren Arzt um Antibiotika zu bitten.
Selbst wenn eine Erkältung zu schmerzhaften Entzündungen der Nasennebenhöhlen führt, müssen nicht immer Antibiotika die Mittel der Wahl sein. Wissenschaftler stellten in einer internationalen Studie fest: Nur etwa fünf von 100 Patienten ging es durch die Entzündungshemmer schneller besser. Besprechen Sie mit Ihrem Arzt daher, ob Behandlungsalternativen wie Schmerzmittel in Frage kommen.
Wenn ein Facharzt Ihnen Antibiotika verordnet, bitten Sie darum, dass Ihr Hausarzt informiert wird. Sie können außerdem selbst notieren, wann Sie welches Antibiotikum in welcher Dosierung eingenommen haben und dies sowohl Haus- als auch Fachärzten mitteilen. So wissen Ihre Ärzte genau, welche Antibiotika Sie wann genommen haben, und können die Behandlung gegebenenfalls anpassen.
Massentierhaltung und industrielle Fleischproduktion spielen eine unrühmliche Rolle bei der Entstehung von Multiresistenzen. Ab und zu ein Biohuhn vom zertifizierten Demeter-Hof macht mehr Appetit und ist gesünder, als mehrmals die Woche Fleisch aus Intensivmast.
Das könnte Sie auch interessieren

Multiresistenzen bei Tuberkulose: DNA-Tests beschleunigen die Diagnose

Antibiotika: fast ein Drittel glaubt, sie helfen gegen Viren
Schuppenflechte: 20 bis 30 Prozent mit Rheuma

Thrombose ohne klare Ursache: Krebsrisiko drei- bis viermal höher